PEMBUATAN LARUTAN 1000 ML Na2S2O3 0,1 N DARI PADATAN Na2S2O3 5H2O

Soal Massa NaOH (mr = 40 ) yang harus di larutkan untuk membuat larutan NaOH yang mempunyai PH=
Kimia. Untuk membuat larutan NaOH 2 molal , diperlukan. JM. Joko M. 01 Januari 2022 01:31. Untuk membuat larutan NaOH 2 molal , diperlukan. ( Ar Na = 23 ) A 8 gram NaOH dan 92 gram H2O B 8 gram NaOH dan 100 gram H2O C 10 gram NaOH dan 90 gram H2O D 4 gram NaOH dan 100 gram H2O E 80 gram NaOH dan 2 liter H2O. 7.
PEMBUATAN LARUTAN 1000 ML Na2S2O3 0,1 N DARI PADATAN Na2S2O3 5H2O
Untuk membuat larutan NaOH 2 molal, Anda perlu menentukan berapa mol NaOH yang diperlukan. Langkah-langkah yang disebutkan di atas menggambarkan cara membuat larutan dengan mengukur berat NaOH. Untuk menghitung berapa banyak NaOH yang diperlukan berdasarkan molari, Anda dapat menggunakan rumus: M = mol/volume (dalam liter)

Pembuatan Larutan Naoh N My XXX Hot Girl
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Untuk membuat 500 mL lar.
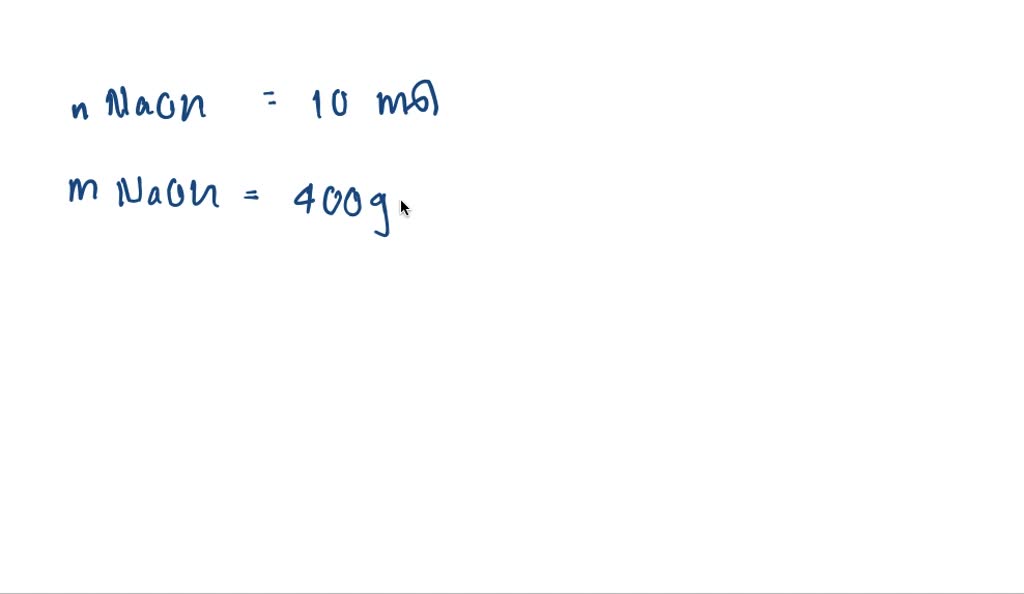
SOLVED Untuk membuat larutan 0,2 molal larutan NaOH disediakan 100 gram air, hitung berapa
Cara Membuat NaOH 40%, 1000 ml. Larutan NaOH 40 % artinya dalam 100 ml larutan mengandung 40 gram NaOH. Jadi untuk membuat NaOH 40 %,1000 ml, massa yang dibutuhkan sebanyak 400 gram NaOH. Timbang 400 gram NaOH, masukkan dalam gelas piala 500 ml. Beri aquadest 400 ml dan aduk hingga larut sempurna. Biarkan dingin.

Untuk membuat larutan NaOH 2 m, massa NaOH yang harus dit...
Untuk membuat larutan NaOH 2 molal diperlukan..(Mr NaOH = 40) 8 gram NaOH dan 92 gram H 2 O. 8 gram NaOH dan 100 gram H 2 O. 10 gram NaOH dan 90 mL H 2 O. 4 gram NaOH dan 100 mL H 2 O. 80 gram NaOH dan 2 Liter H 2 O. 19. Multiple Choice. Edit. 30 seconds. 1 pt.
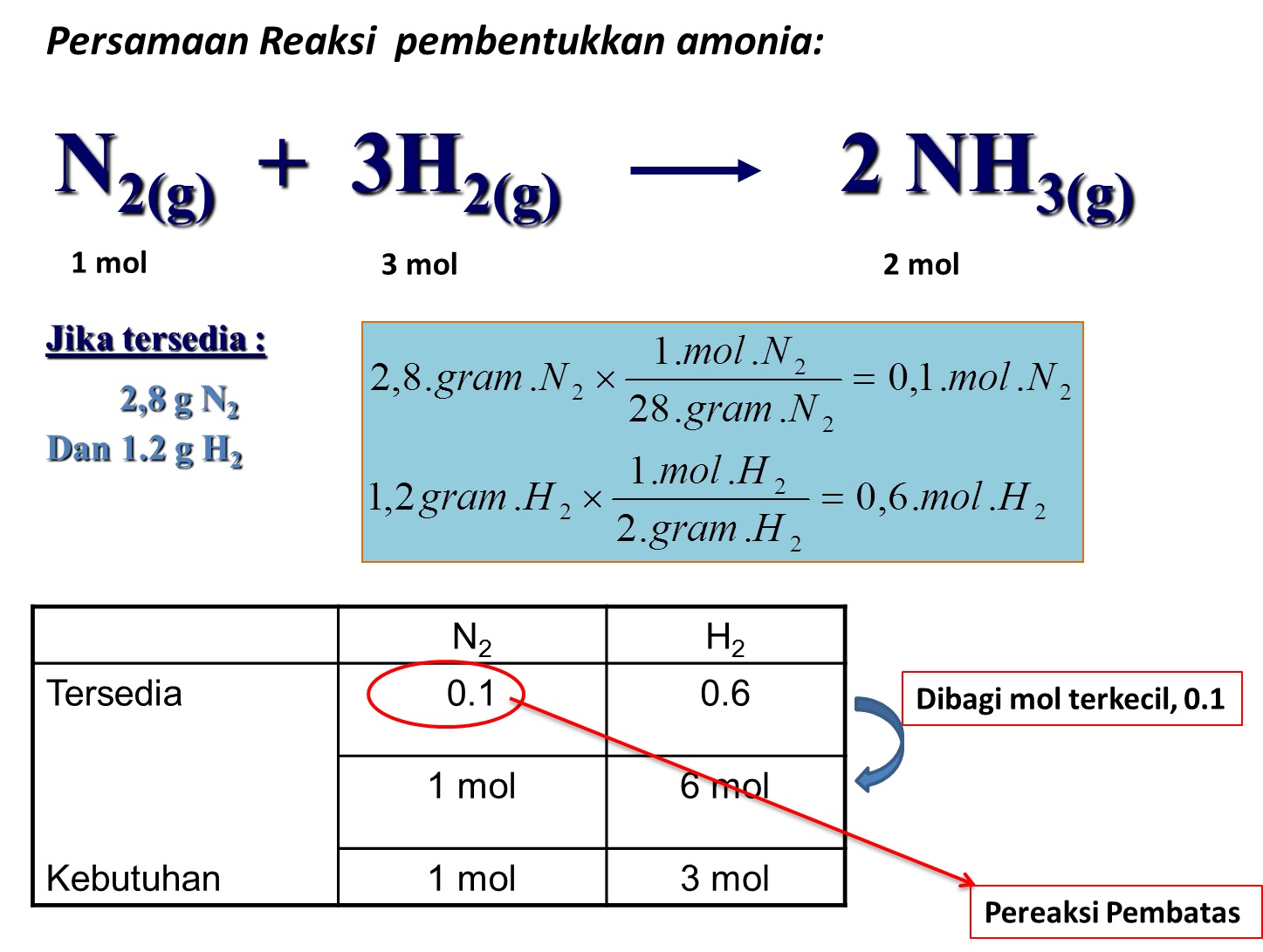
5 Tahapan Reaksi Kimia kabarmedia.github.io
Untuk membuat larutan NaOH (Mr = 40) 0,05 M sebanyak 2 L, maka x mL larutan NaOH 8% dengan massa jenis 1 , 25 gram / cm 3 ditambahkan y mL air. Nilai x dan y adalah. mL. (Utul UGM 2018)

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
Untuk membuat larutan NaOH 2 molal diperlukan..(Mr NaOH = 40) 8 gram NaOH dan 92 gram H 2 O. 8 gram NaOH dan 100 gram H 2 O. 10 gram NaOH dan 90 mL H 2 O. 4 gram NaOH dan 100 mL H 2 O.. Untuk membuat larutan urea konsentrasi 0,1 m. maka massa urea yang dilarutkan dalam 50 ml air adalah….. gram (Mr urea = 60, massa jenis air = 1 gr/ml) 3.

Cara pembuatan larutan NaOH 0.1N sebanyak 500 ml (Ilustrasi) YouTube
Untuk lebih memahami teori tersebut, berikut beberapa contoh soal dan pembahasan perhitungan mol.. m = 0,2 x (1000/400) = 0,5 molal. soal 4: Jelaskan prosedur membuat larutan NaOH 0,2 M sebanyak 500 mL (Mr NaOH adalah 40). Artikel lainnya: Metode lumpur aktif sebagai aplikasi redoks. Pembahasan soal 4: Langkah pertama: menghitung massa NaOH.
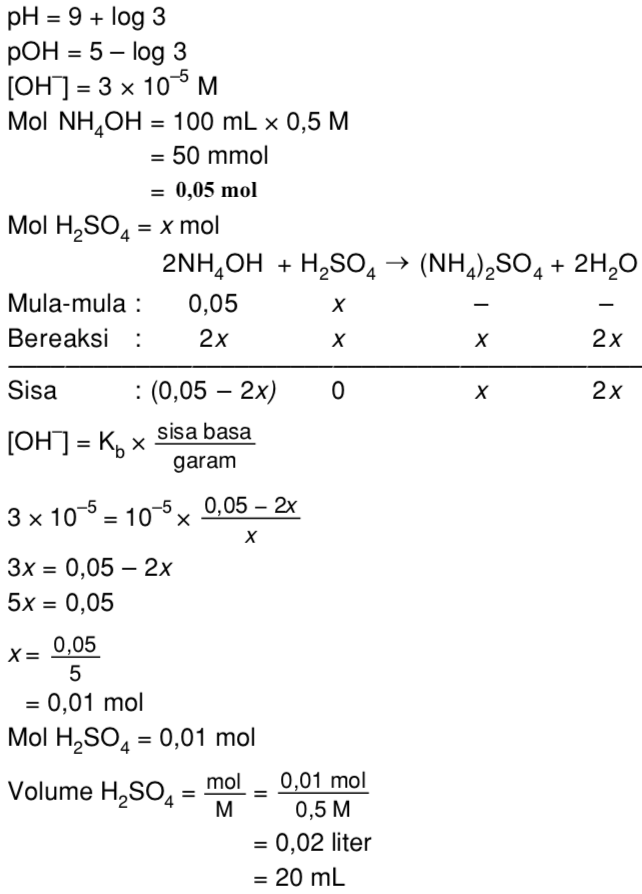
Berapa mL larutan H2SO4 0,5 M yang harus ditambahkan ke dalam 100 mL larutan NH4OH 0,5 M Mas Soal
Untuk membuat larutan NaOH 2 molal, diperlukan.. (Ar Na=23) A. 8 gram NaOH dan 92 gram H2O B. 8 gram NaOH dan 100 gram H2O C. 10 gram NaOH dan 90 mL H2O D. 4 gram NaOH dan 100 mL H2O E. 80 gram NaOH dan 2 liter H2O. Satuan Konsentrasi Larutan. Sifat Koligatif Larutan. Kimia Fisik dan Analisis. Kimia.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Massa larutan dapat kita hitung dengan rumus, ml = mp + mc = 25 gr + 100 gr = 125 gr. Jadi, massa larutannya sebesar 125 gr. Selanjutnya kita hitung konsentrasinya dengan rumus, C = (25 : 125) x 100%. C = 0,2 x 100% = 20%. Soal No. 2. Diketahui konsentrasi larutan gula dalam air adalah 30%. Massa larutan gula tersebut sebesar 500 gram. Berapakah

Untuk Menentukan Kemolaran Larutan Naoh Lengkap
Soal dan Jawaban Konsentrasi Larutan: Molaritas, Molalitas, Fraksi Mol, Persen Berat, Normalitas. 1. Konversi molal ke % massa. Contoh soal: Hitunglah % massa dari larutan NaI 0,2 molal (massa molar NaI = 150 g/mol) Penyelesaian: Arti 0,2 molal NaI adalah 0,2 mol NaI dalam 1 Kg pelarut air. massa NaI sebanyak 0,2 mol = 0,2 mol x 150 g/mol = 30 g.

Data hasil percobaan titrasi larutan NaOH dengan larutan
Untuk membuat larutan NaOH 2 molal diperlukan.. (Mr NaOH = 40) A. 8 gram NaOH dan 92 gram H 2 O. B. 8 gram NaOH dan 100 gram H 2 O. C. 10 gram NaOH dan 90 mL H 2 O. D. 4 gram NaOH dan 100 mL H 2 O. E. 80 gram NaOH dan 2 Liter H 2 O. Soal nomor 19. Gambar di bawah ini merupakan gambar partikel zat terlarut dan pelarut yang bukan sebenarnya.

Sebanyak 2 gram cuplikan NaOH dilarutkan dalam 250 mL air...
Halo Ko Friends pada saat ini kita disuruh mencari massa NaOH yang harus ditambahkan ke dalam 250 gram air sehingga larutan NaOH tersebut memiliki konsentrasi sebesar 2 molal diketahui molalitas dari NAOH adalah 2 molal massa dari air adalah 250 gram atau jika kita jadikan kg akan menjadi 0,25 kilo pula dari data ar akan didapat Mr daripada NaOH sebesar 23 + 16 + 1 yaitu 40 gram per mol yang.

Dari hasil titrasi larutan NaOH 0,1 M dengan larutan HCl
Kimia. Kimia Fisik dan Analisis Kelas 10 SMA. Hukum-Hukum Dasar Kimia dan Stoikiometri. Konsep Mol dan Hubungannya dengan Jumlah Partikel, Massa Molar, dan Volume Molar. Berapa gram NaOH yang diperlukan untuk membuat larutan NaOH 0,5 M sebanyak 1 liter ? (Mr NaOH=40) A. 32 gram B. 16 gram C. 20 gram D. 4 gram E. 2 gram.

Untuk Menentukan Kemolaran Larutan Naoh Lengkap
Cara Membuat Larutan NaOH 1 N (1 M) sebanyak 1000 ml. 1 = (massa x 1)/ (40 x 1L), ( ingat volume dalam Liter !!!) Jadi NaOH yang perlu ditimbang sebanyak 40 gram. Timbang NaOH sebanyak 40 gram kemudian masukkan dalam gelas piala ( ukuran 200 ml ). Larutkan dengan aquadest dan tunggu sampai dingin. Setelah dingin masukkan larutan NaOH ke dalam.

Ide 25+ Alat Laboratorium Yang Digunakan Untuk Membuat Larutan Dengan Konsentrasi Dan Volume
Contoh : Membuat larutan NaOH 0,1 M sebanyak 1 liter (Mr NaOH = 40 gr/mol ). Maka harus menghitung dulu berapa gram NaOH yang dibutuhkan. Caranya dengan mengunakan rumus molaritas : M = gr/Mr x 1000/V. 0,1 M = gr/40 x 1000/1000ml. gr = 4 gram. Maka NaOH yang dibutuhkan untuk membuat NaOH 0,1 M yaitu 4 gram.