Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal

Kestabilan Atom Ikatan Kimia Dan Bentuk Molekul Riset
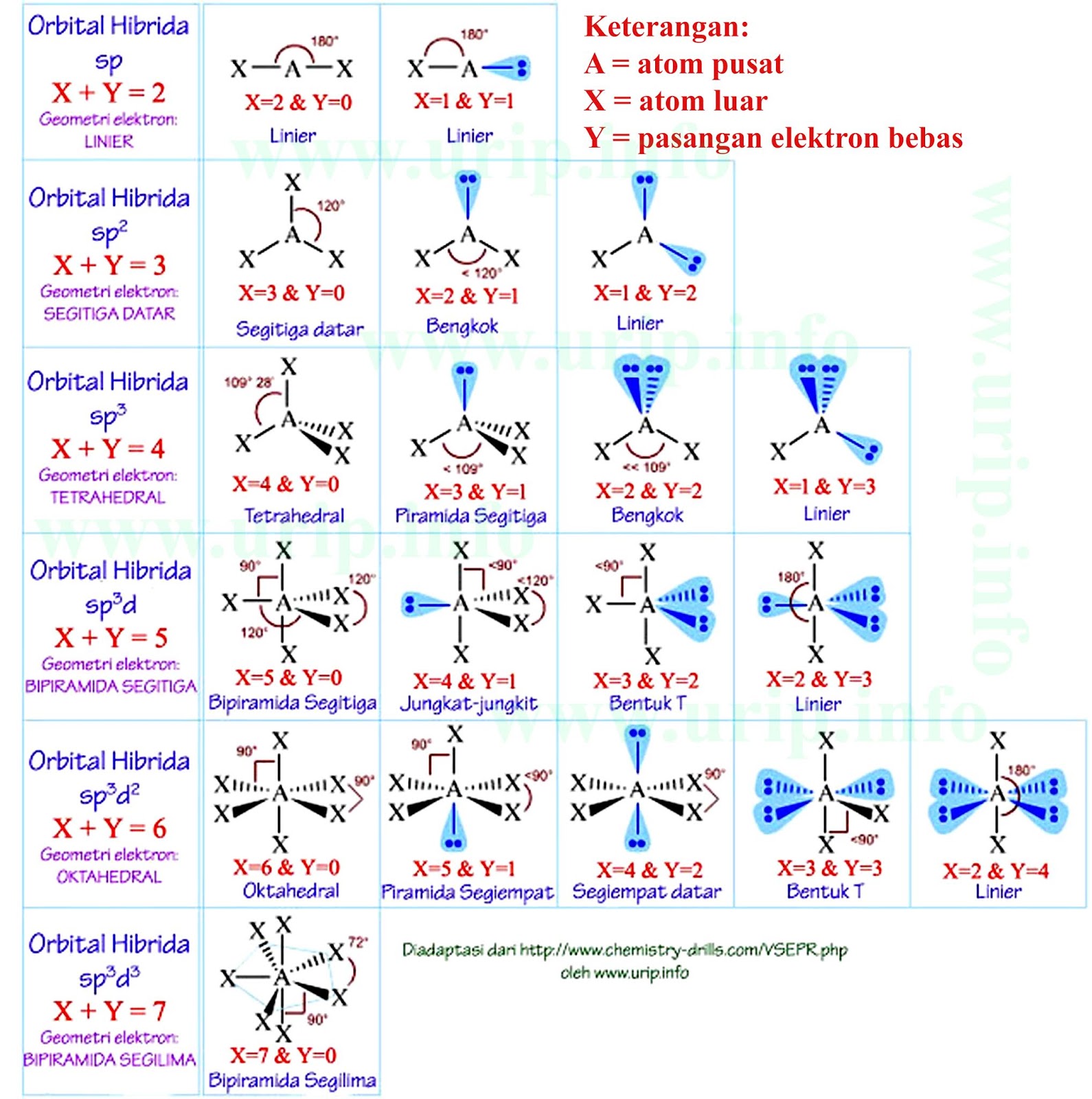
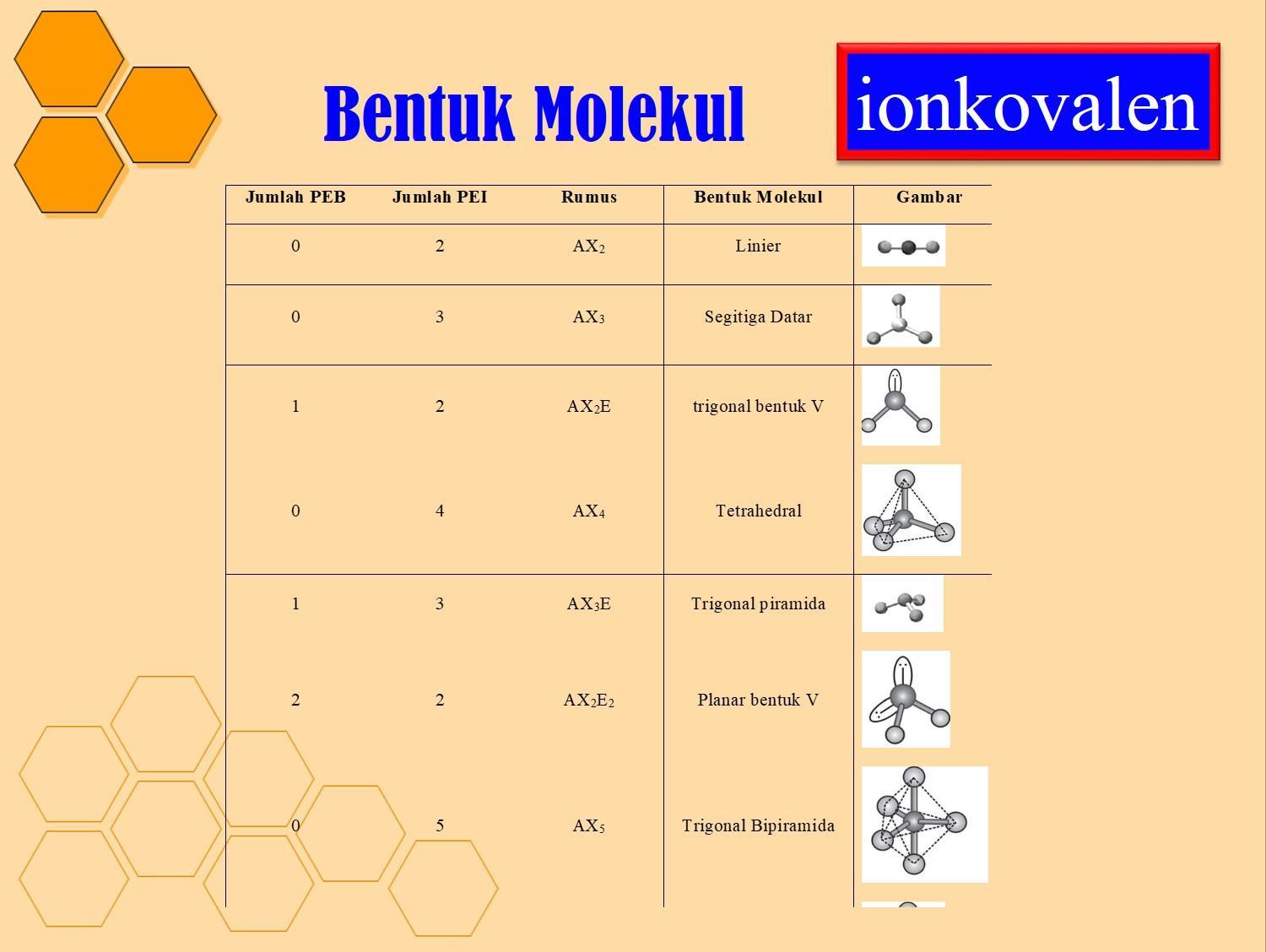
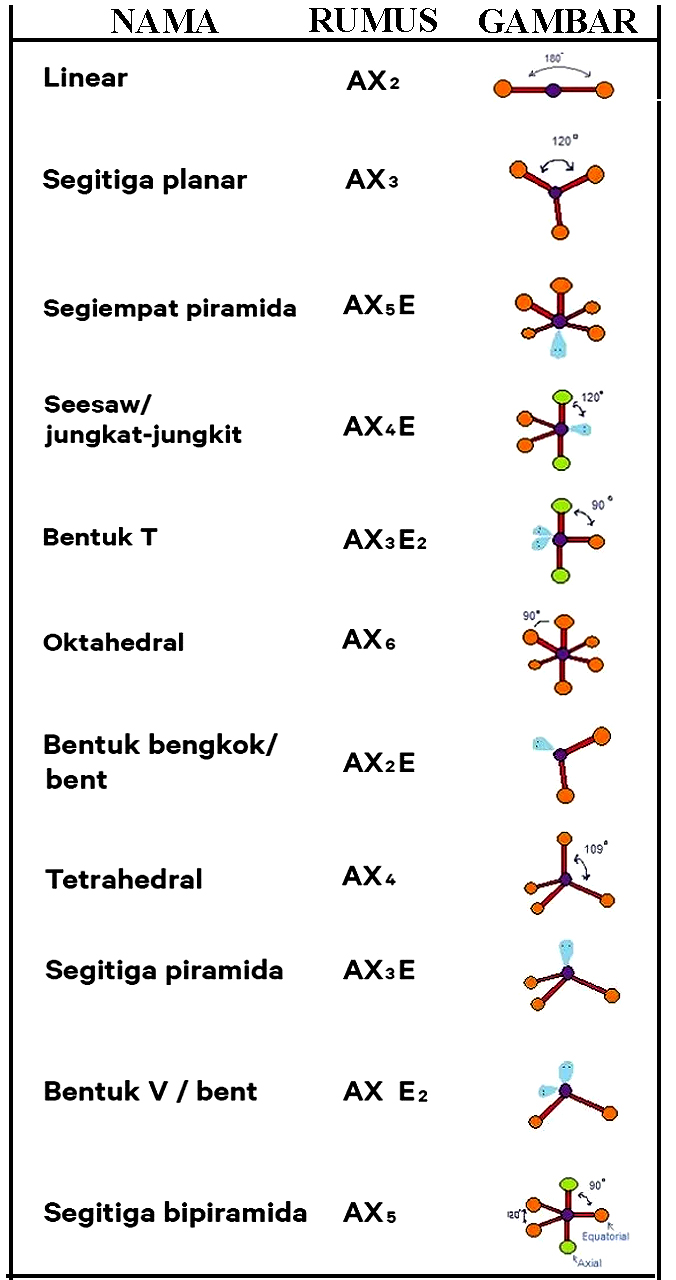
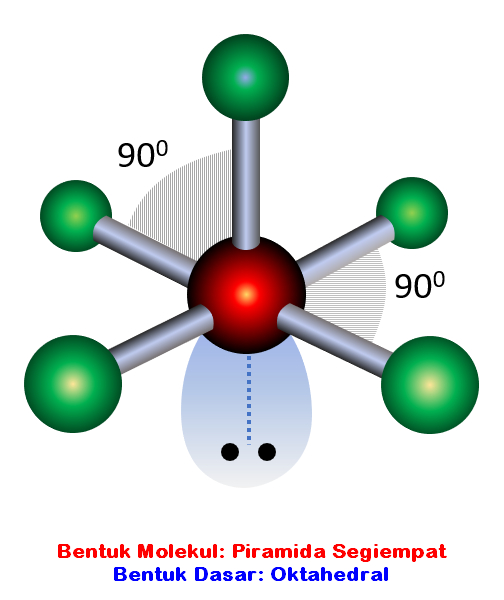
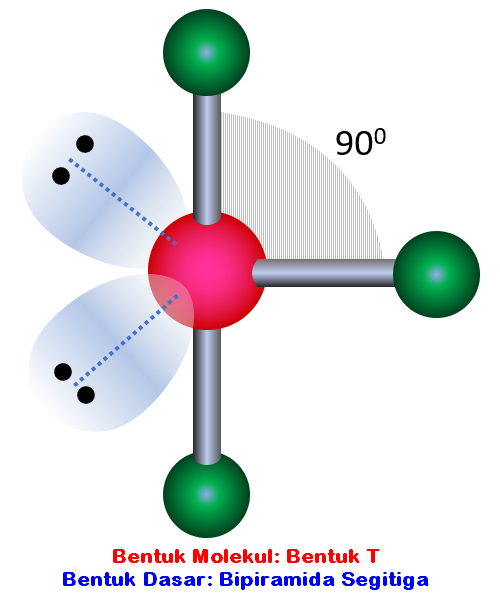
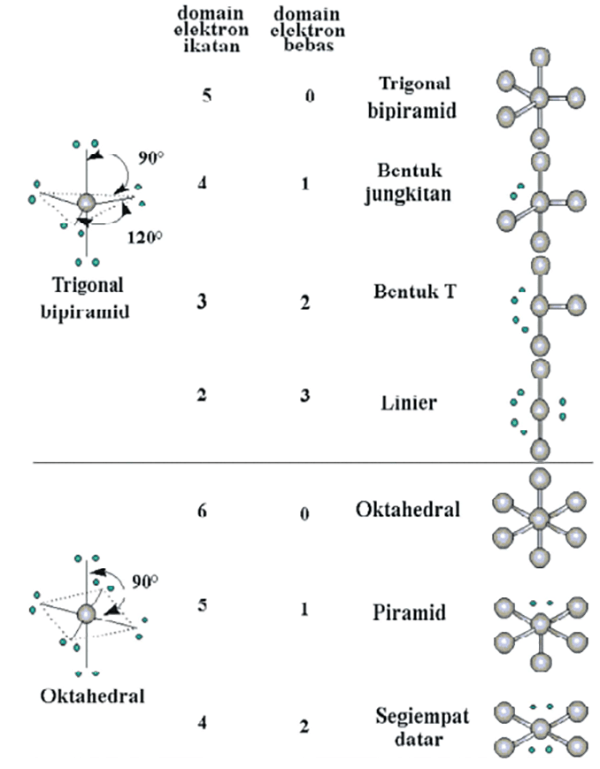
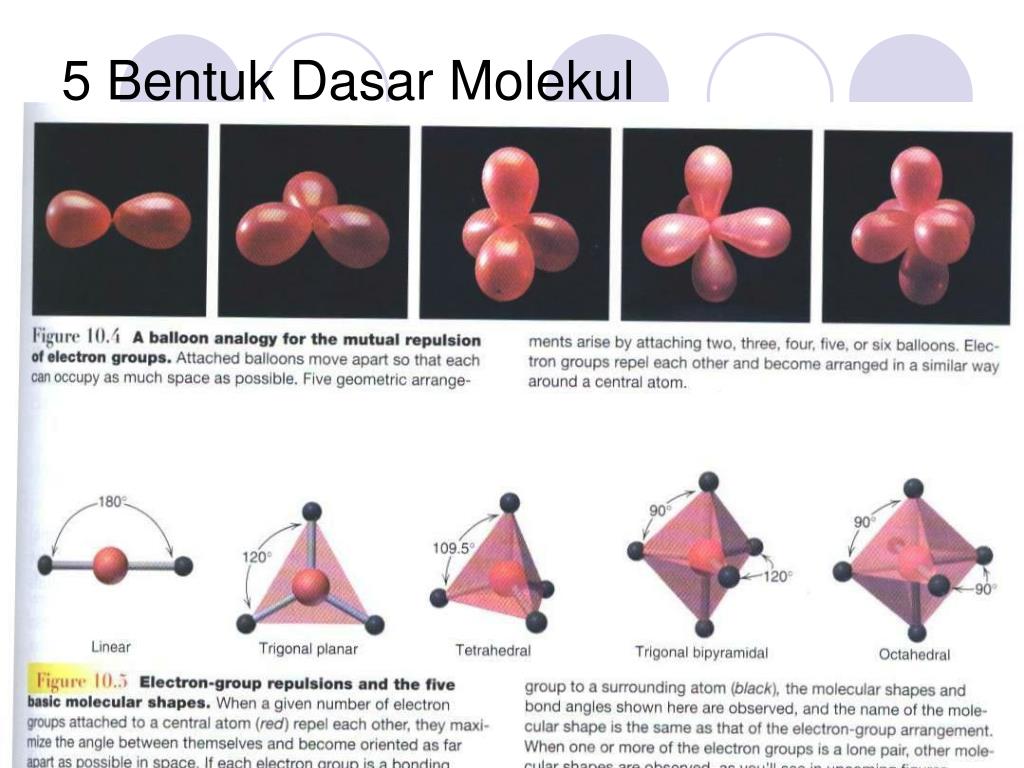
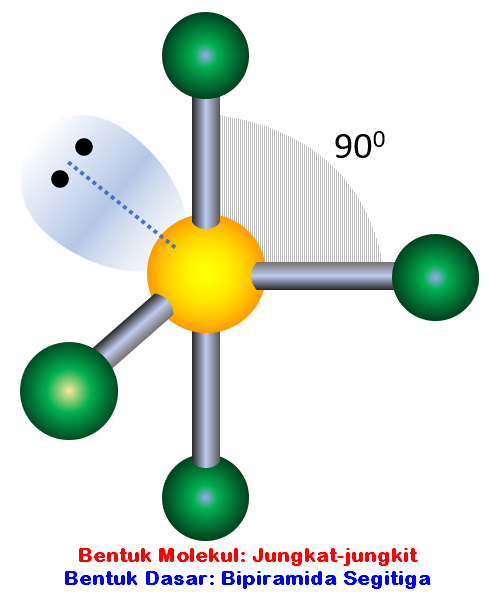
n: jumlah PEI dalam molekul. E: pasangan elektron bebas (PEB) m: jumlah PEB dalam molekul. Ada 11 bentuk molekul berdasarkan teori domain elektron, yaitu linear, segitiga planar, segiempat piramida, seesaw atau jungkat-jungkit, bentuk T, oktahedral, bentuk bengkok, tetrahedral, segitiga piramida, bentuk V, dan segitiga bipiramida.

Daftar Tabel Gambar Molekul
Ikatan kimia secara umum terbagi menjadi dua yaitu, ikatan antar atom dan ikatan antar molekul. Ikatan antar atom melibatkan ikatan ion atau ikatan elektrovalen, ikatan kovalen, ikatan kovalen koordinasi dan ikatan logam. Dan ikatan atar molekul melibatkan ikatan van der walls dan ikatan hidrogen. Teori VSEPR digunakan untuk memprediksi bentuk.
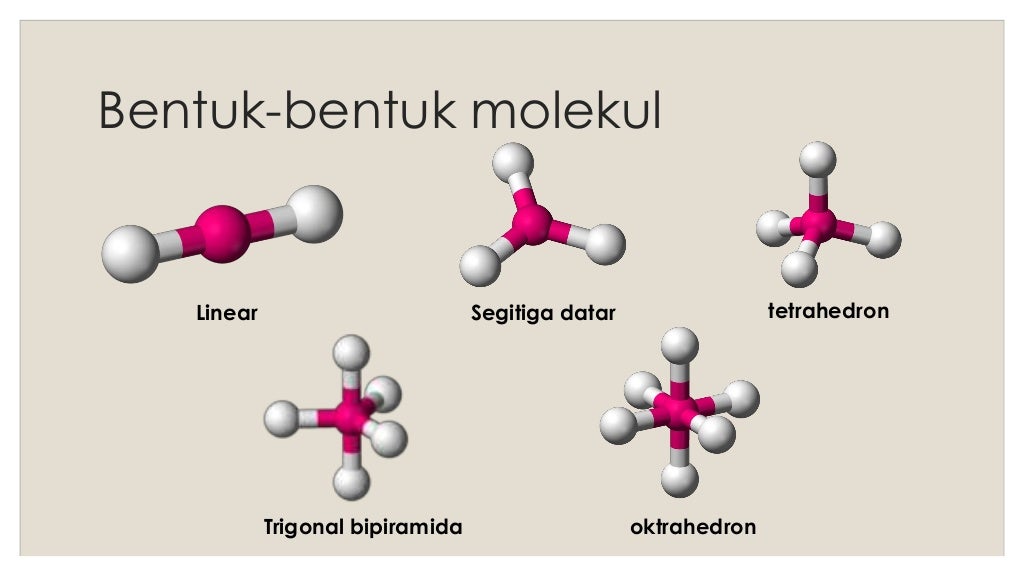
Bentuk molekul
Jumlah cara penyusunan atom dalam molekul tidak banyak sebab dibatasi oleh sudut antarikatan dan sifat partikel penyusunnya. Teori yang mengkaji aspek struktur molekul adalah teori ikatan valensi (berdasarkan mekanika kuantum), teori domain elektron (berdasarkan teori Lewis), dan teori hibridisasi. Terdapat sekitar tujuh bentuk molekul yang.
Senyawaan Belerang, Ikatan Kimia, Hibridisasi, Bentuk Molekulnya Markas Belajar
Bagikan. Mengenal Bentuk Molekul pada Materi Kimia Kelas 10 Beserta Penjelasannya - Di sekolah kamu akan mempelajari bentuk molekul pada materi kimia kelas 10. Molekul sendiri bisa dipahami sebagai kumpulan dari atom-atom yang saling terikat. Agar lebih jelas, pada kesempatan kali ini Mamikos telah merangkum materi tentang molekul, bentuk.
Detail Bentuk Bentuk Molekul Beserta Gambarnya Koleksi Nomer 13
Bentuk molekul merupakan gambaran secara teoritis kedudukan atom-atom di dalam suatu molekul yang digambarkan secara tiga dimensi. Atom-atom yang terdapat di dalam molekul tersusun dengan panjang dan sudut ikatan tertentu. Cara menentukan bentuk molekul senyawa kimia dapat dilakukan dengan menggunakan teori domain elektron dan teori hibridisasi.
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
2. Diagram orbital molekul N2 N 2 dan O2 O 2. 3. Orde Ikatan. Dalam molecular orbital theory, kestabilan ikatan kovalen berhubungan dengan orde ikatan. Jika nilai orde ikatan lebih besar dari 0, berarti molekul tersebut stabil sedangkan jika nilai orde ikatan sama dengan 0, maka molekul tersebut tidak stabil.
Download Gambar Bentuk Molekul dan Cara Memanfaatkannya Urip dot Info
Teori Bentuk Molekul. 1. Teori VSEPR. Bunyi teori VSEPR adalah pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron "mandiri") saling tolak-menolak, pasangan elektron cenderung untuk berjauhan satu sama lain.

Download Gambar Bentuk Molekul dan Cara Memanfaatkannya Urip dot Info
Berbeda untuk menentukan kepolaran molekul yang terdiri dari lebih dari dua atom (poliatomik). Bila keelektronegatifan berbeda dipastikan molekul diatomik itu bersifat polar. Namun demikian ada batas beda toleransi. Seperti molekul HCl. Keelektronegatifan: H = 2,20 dan Cl = 3,16. Perbedaan (x) sebesar 3,16 - 2,20 = 0,96.
Download Gambar Bentuk Molekul dan Cara Memanfaatkannya Urip dot Info
Bentuk molekul ini sebenarnya bisa dijelaskan dengan berbagai teori salah satunya adalah teori hibridisasi orbital. Selain itu juga dapat diketahui melalui teori medan kristal atau Crytal Field Theory, dan teori tolakan pasangan elektron atau yang dikenal dengan VSPR (Valence Shell Electron Pair Repulsion).. Penting untuk diketahui bahwa pasangan-pasangan elektron tersebut di dalam molekul.
Cara Menentukan Bentuk Geometri Molekul
A. Pengertian Ikatan Kimia. Ikatan kimia adalah gaya tarik menarik yang kuat antara atom-atom tertentu bergabung membentuk molekul atau gabungan ion-ion sehingga keadaannya menjadi lebih stabil. Dua atom atau lebih dapat membentuk suatu molekul melalui ikatan kimia. Ikatan kimia terjadi karena penggabungan atom-atom, yang membentuk molekul.

Tabel Bentuk Geometri Molekul
Explore molecule shapes by building molecules in 3D! Find out how a molecule's shape changes as you add atoms to a molecule.

Download Gambar Bentuk Molekul dan Cara Memanfaatkannya Urip dot Info
Rangkuman 2 Geometri dan Bentuk Molekul. Rangkuman 3 Geometri dan Bentuk Molekul. Rangkuman 4 Geometri dan Bentuk Molekul. Rangkuman 5 Geometri dan Bentuk Molekul. Kuis Akhir Geometri dan Bentuk Molekul. 675. 300. Materi pelajaran Kimia untuk Kelas 11 Kurikulum Merdeka bab Bentuk Molekul dan Gaya Antarmolekul⚡️ dengan Geometri dan Bentuk.

Tabel Bentuk Geometri Molekul
Jelajahi bentuk molekul dengan membuat molekul dalam 3D! Bagaimana bentuk molekul berubah dengan jumlah ikatan dan pasangan elektron yang berbeda? Cari tahu dengan menambahkan ikatan tunggal, ganda, atau rangkap tiga dan pasangan elektron bebas ke atom pusat. Kemudian, bandingkan model dengan molekul nyata! Versi dasar simulasi ini cocok untuk siswa yang baru belajar tentang bentuk molekul.
PPT BENTUK MOLEKUL PowerPoint Presentation, free download ID3809364
Oleh karena itu, gaya antar-molekul berbeda dari ikatan kimia. Ikatan kimia yang mencakup ikatan ionik, kovalen, dan logam terjadi antar-atom dalam membentuk molekul. Ikatan ini lebih kuat dar gaya antar-molekul. Sifat fisik dari zat dikukur tanpa adanya perubahan komposisi kimia lain zat diteliti. Itu artinya, ikatan kimianya tidak dipengaruhi.

Struktur Molekul Bentuk molekul Molekul Linier sudut ikatan
Untuk memahami ikatan kovalen polar dan nonpolar silahkan kalian baca artikel tentang definisi, ciri-ciri dan perbedaan ikatan kovalen polar dan nonpolar. Polaritas atau kepolaran suatu senyawa dinyatakan dengan momen dipol (μ), yaitu hasil kali antara muatan (δ) dengan jarak (r). Secara matematis, rumus momen dipol dituliskan sebagai berikut.
Pembahasan Soal Kimia Nomor 32 SBMPTN 2018 Semua Kode Soal Bentuk Molekul dan Kepolaran
3. Hubungan Bentuk Molekul dan Kepolaran Senyawa. Molekul-molekul yang memiliki ikatan kovalen ada yang bersifat polar, Ukuran kuantitatif kepolaran ikatan adalah momen dipol µ, yang merupakan hasil kali muatan Q dan jarak antar muatan r : Momen dipol biasanya dinyatakan dalam satuan debye D, yang diambil dari nama seorang kimiawan Belanda.