Ejercicios de ley de proporciones recíprocas o ley de Richter YouTube

Ejercicios de ley de proporciones recíprocas o ley de Richter YouTube
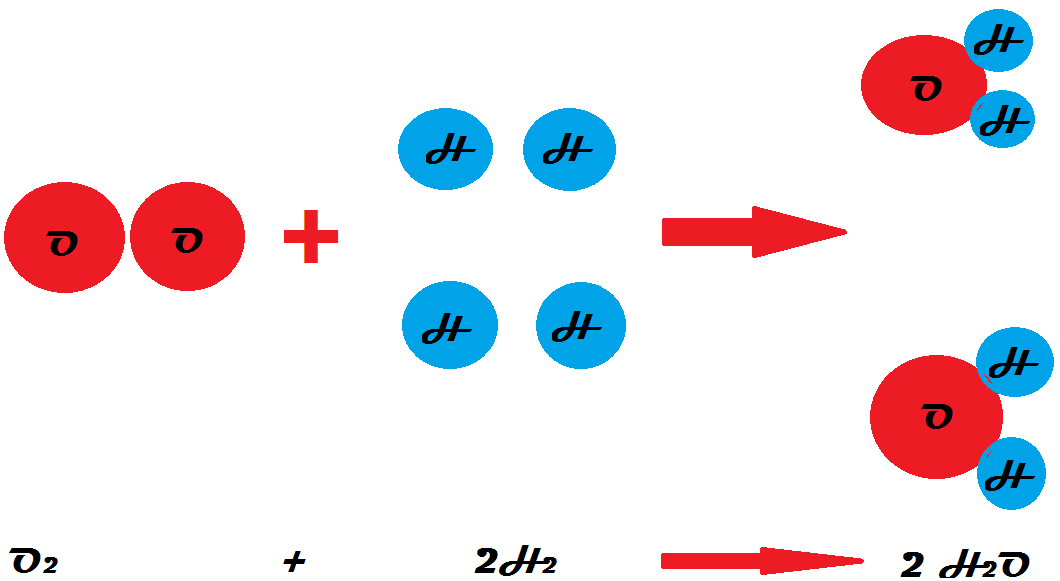
La ley de las proporciones recíprocas es fundamental en química y se refiere a la relación inversa entre las cantidades de reactivos y productos en una reacción química. Un ejemplo es la reacción de formación de monóxido de nitrógeno, en la que 4,66 gramos de nitrógeno reaccionan con 8 gramos de oxígeno según la ley de las proporciones recíprocas.

19. Ley de las proporciones constantes. (con imágenes) Ley, Proporciones, Constante
La Ley de Proporciones Equivalentes o Ley de las Proporciones Recíprocas es una ley enunciada por Ritcher en 1792 y que afirma: Los pesos de diferentes elementos que se combinan con el mismo peso de un elemento determinado, guardan la misma relación de pesos cuando se combinan entre sí o con múltiplos o submúltiplos de estos

Ley de proporciones recíprocas o RichterWenzel ejemplos de la vida cotidiana Brainly.lat
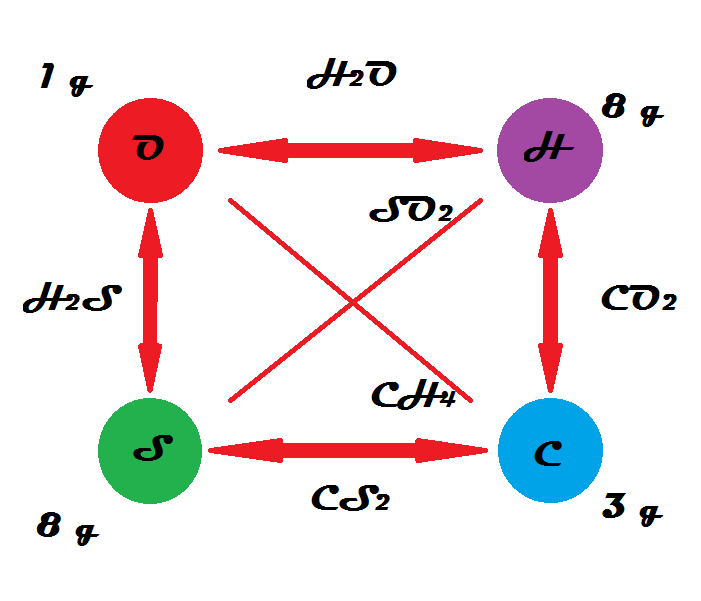
Triángulo de reciprocidad. Fuente: Gabriel Bolívar ¿Qué es la ley de Richter-Wenzel? La ley de Richter-Wenzel, o de las proporciones recíprocas, es la que establece que las proporciones másicas entre dos compuestos permiten determinar la de un tercer compuesto.

Ley De Las Proporciones Reciprocas Ejemplos Nuevo Ejemplo
La ley de las proporciones equivalentes llamada también de los pesos de combinación, fue esbozada por Richter en 1792 y completada varios años más tarde por Wenzel. «Los pesos de los diferentes elementos que se combinan con un mismo peso de un elemento dado, son los pesos relativos a aquellos elementos cuando se combinan entre sí, o bien.

Micro Ley de las Proporciones Definidas YouTube
Según la ley de las proporciones recíprocas, 4,66 gramos de nitrógeno deben ser capaces de reaccionar con 8 gramos de oxígeno. N2 + O2 -> 2 NO En esta reacción de formación de monóxido de nitrógeno, tenemos que 28 gramos de nitrógeno reaccionan con 32 gramos de oxígeno. Entonces si observamos que:
Ley de las proporciones recíprocas
La ley de las proporciones recíprocas es una de las llamadas leyes estequiométricas y fue enunciada por primera vez por Jeremías Benjamín Richter en 1792 en el libro que estableció los fundamentos de la estequiometría. HISTORIA La historia de la ley LA HIZO: En 1777 se publicó por primera vez las tablas de pesos de equivalencia.

Leyes fundamentales de la Química FisiQuímicamente
Las leyes ponderales de la química son aquellas reacciones químicas que expresan relaciones numéricas que pueden establecerse entre las sustancias que intervienen en una reacción determinada. Las leyes ponderales son la ley de la conservación de la masa, de Lavoisier, la ley de Proust, o de las proporciones constantes, la ley de Dalton, o.

Free download Ley de las proporciones equivalentes Law of definite proportions Law of multiple
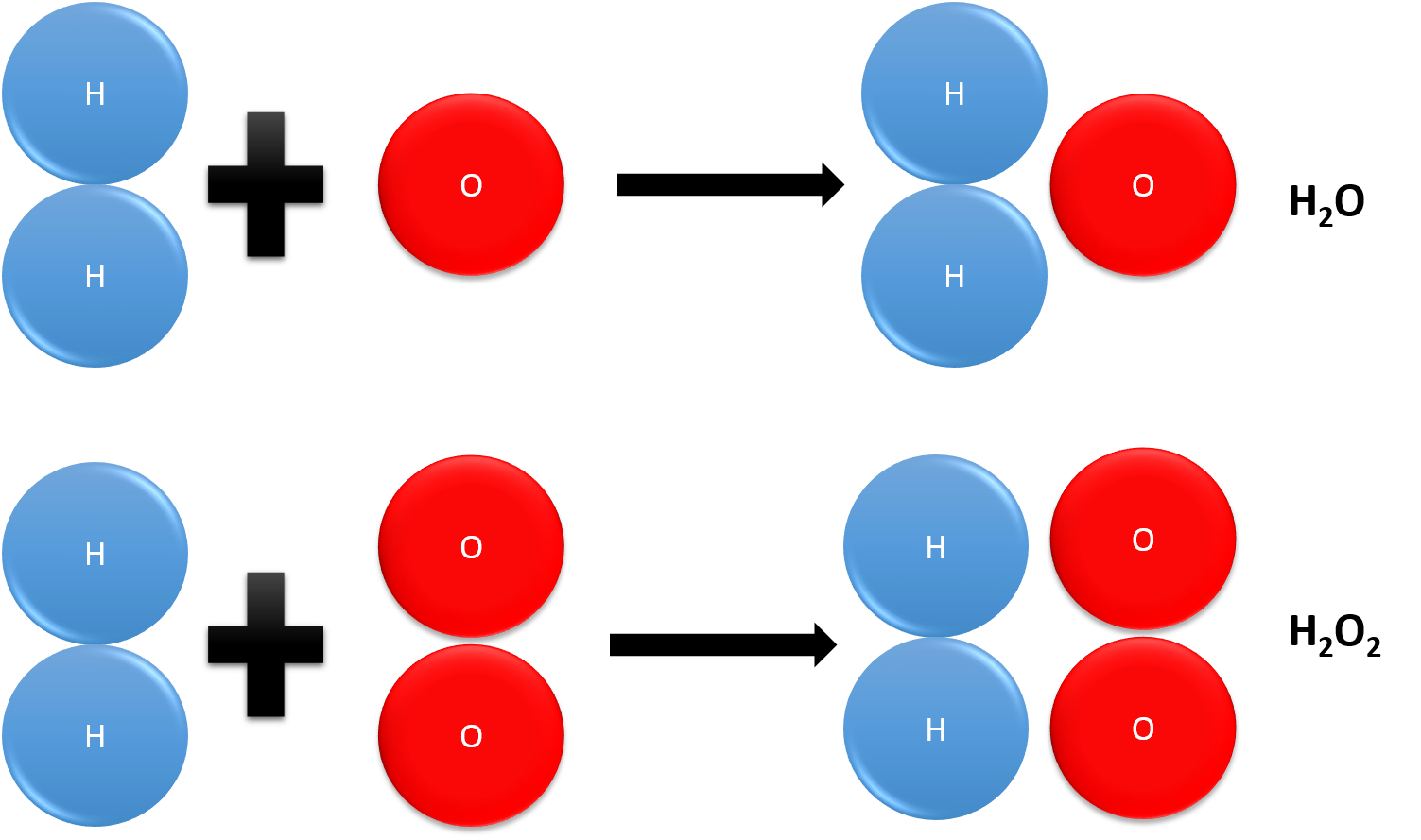
Ley de las Proporciones Definidas se expresa así: "Diferentes átomos se combinan en relaciones simples de números enteros para formar compuestos". Dicho de otra manera, un compuesto siempre está constituido por los mismos elementos y en la misma proporción en masa. Sin embargo, existen elementos que al combinarse entre sí forman más de un compuesto. Observa el siguiente ejemplo: Los.
Ley de las proprociones definidas
Ley de Proporciones Definidas. El descubrimiento de que la masa siempre se conservó en reacciones químicas fue seguido pronto por la ley de proporciones definidas, que establece que un compuesto químico dado siempre contiene los mismos elementos en las mismas proporciones exactas en masa. Como ejemplo, cualquier muestra de agua pura contiene.
PROFESORADO DE EDUC. SECUNDARIA EN QUÍMICA CLASE 2A LEYES PONDERALES DE LAS REACCIONES QUÍMICAS
La ley de Dalton o la ley de las proporciones múltiples dice que cuando se combinan una masa fija de una sustancia con otra sustancia de diferentes masas, formando compuestos diferentes, las masas de otra sustancia varía en una proporción de números enteros y pequeños. 2 g de hidrógeno + 16g de oxígeno 18 g de agua.

Ley De Las Proporciones Reciprocas Ejemplos Nuevo Ejemplo
La ley de las proporciones recíprocas es un principio fundamental de la química que establece una relación entre los componentes de una reacción química. Esta ley establece que si dos o más reactivos se combinan para formar un producto, la proporción en la que los reactivos se combinan es inversamente proporcional a sus pesos atómicos.

Ley de proporciones recíprocas Estequiometría Quimica Quimica
Ley de las proporciones recíprocas o ley de Richter-Wenzel es una de las llamadas leyes estequiométricas, fue enunciada por primera vez por Jeremias Benjamin.

ESTEQUEOMETRÍA LEY DE PROPORCIONES RECIPROCAS CLASE TUTORIAL QuimiCiencia YouTube
Ley de proporciones recíprocas - Estequiometría Fue planteada por J.B. Ritcher y C.F. Wenzel en 1702, quien establece lo siguiente: las masas de diferentes elementos que se combinan con una misma masa de otro elemento dan la relación en que se combinarán entre sí, o bien múltiplos o submúltiplos de estas masas. Ejemplo 1:

LEY DE PROPORCIONES RECIPROCAS 1ºM 02de NOV. YouTube
En qué consiste la ley de las proporciones definidas. Se le conoce como la ley de las proporciones constantes o ley de las proporciones definidas y consiste en una ley estequiometria que fue enunciada en el año 1799.Esta ley establece que cuando se combinan dos o más elementos para lograr un determinado compuesto siempre se combinarán en una proporción constante de masas.

Ley de las proporciones múltiples
La ley de las proporciones recíprocas o también ley de Richter-Nathan es una de las llamadas leyes estequiométricas y fue enunciada por primera vez por Jeremías Benjamín Richter en 1792 en el libro que estableció los fundamentos de la estequiometría, que completó el trabajo realizado previamente por Carl Friedrich Wenzel, quien en 1777 publicó por primera vez tablas de pesos de.

Leyes ponderales de la química ¿Qué son y cuáles son?
La Ley de las Proporciones Recíprocas es un principio fundamental en la química que establece que cuando dos o más elementos se combinan para formar un compuesto, las cantidades relativas de los elementos involucrados en la reacción están en una proporción simple y definida.